近日,生物治疗全国重点实验室余雅梅副研究员/陈强研究员团队在Molecular Cell(IF: 16.0)发表论文《Multiple enzymatic activities of a Sir2-HerA system cooperate for anti-phage defense》,在Nature Structural & Molecular Biology(IF: 16.8)发表论文《PtuA and PtuB assemble into an inflammasome-like oligomer for anti-phage defense》,揭示了新型抗噬菌体防御系统Nezha与Septu的分子组装与抗噬菌体机制。
在漫长的进化过程中,细菌和噬菌体之间通过复杂的生物“军备竞赛”,发展出了多种多样的生物“武器”。细菌进化出了一系列抵抗噬菌体的防御系统,如经典的限制性修饰(RM)系统、CRISPR-Cas系统、毒素-抗毒素(TA)系统等。2023年12月21日,生物治疗全国重点实验室余雅梅副研究员/陈强研究员团队在Molecular Cell发表论文,详细阐述了一种新发现的细菌防御系统如何通过多种酶活性来共同抵御噬菌体侵袭的机制。

余雅梅副研究员、陈强研究员为共同通讯作者,泌尿外科博士后唐冬梅、生物治疗全国重点实验室硕士研究生陈怡君共同第一作者,我院为该成果唯一完成单位,
研究团队将这一系统命名为“Nezha”,灵感源自中国古代神话人物哪吒,象征着多种防御机制的协同作用。“Nezha”系统的核心功能涵盖ATP感知、ATP水解活性、NAD水解活性、解旋酶活性和核酸酶活性。这些功能共同协作,构成了一种复杂高效的防御机制,有效抵抗噬菌体的攻击。国外曾用西方神话中的神灵给新发现的细菌防御系统命名,而“Nezha”是首个以中国神话人物命名的细菌防御系统。
“Nezha”系统中的这些酶活性能够相互协作,产生协同效应。例如,ATP水解活性和NAD水解活性的结合,加上ATP对这些活性的负调节,形成了一个典型的正反馈机制,可以迅速降低细胞内ATP水平,从而激活“Nezha”系统。被激活的“Nezha”系统发挥解旋酶活性,特异性地识别并解旋复制中噬菌体的双链DNA,将其转化为单链DNA,而单链特异性核酸酶活性会降解这些单链DNA,同时不会损害细胞自身的双链基因组。这一复杂而精密的机制展示了细菌如何利用高度专门化的分子机制,以抵御外来的病毒性威胁。
研究团队通过冷冻电镜(Cryo-EM)技术解析了“Nezha”复合物结构,发现十二个Sir2分子和六个HerA分子组装成一个巨大的复合物(图2)。文章详细描述了这个巨大的复合物是如何组装起来的,并通过结构比较阐明了“Nezha”具有多种酶活性的分子机制。
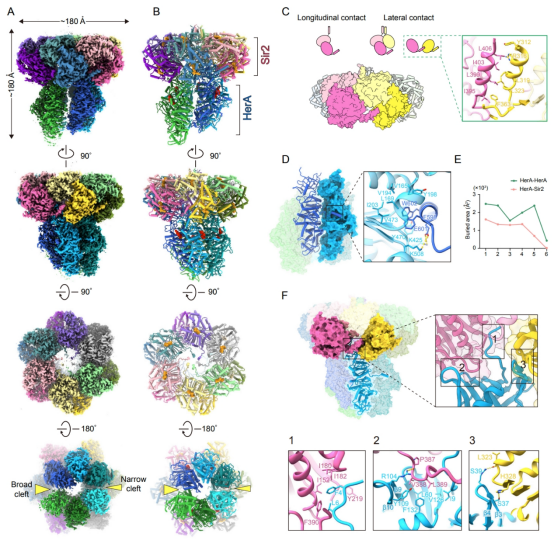
图1 “Nezha”复合物的结构和组装
结合生化、细胞、结构、质谱等多种实验技术,研究团队提出了“Nezha”系统多种酶活性协同防御噬菌体感染抵抗噬菌体侵染的完整机制(图2):首先,当噬菌体侵入并感染细菌时,“Nezha”系统能够感知到噬菌体基因组的复制活动。这种感知触发了系统中ATP水解酶活性的增强,进而导致细胞内ATP水平的降低。ATP水平的下降是“Nezha”系统其他酶活性激活的关键信号。在这些酶活性的共同作用下,噬菌体基因组被有效清除。随着噬菌体基因组的消除,系统中的ATP水解酶活性随之下调,导致细胞内ATP水平逐渐恢复正常。这种ATP水平的恢复,反过来抑制了“Nezha”系统中其他酶的活性,最终导致整个系统的关闭。这一过程确保了细菌在噬菌体感染被清除后,能够恢复正常生长和功能。该研究揭示了一个能够自动调节的多功能系统,为细菌的抗噬菌体机制的精密调节提供了一个范例。
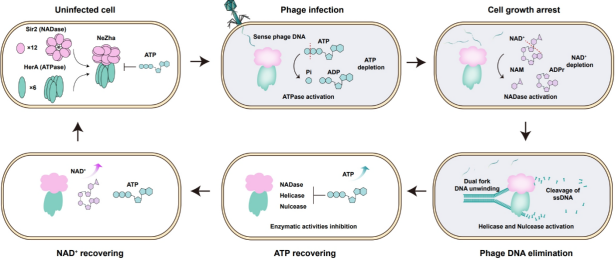
图2 “Nezha”系统的多种酶活性协同防御病毒感染
Septu系统是近年来基于“防御岛”特性,运用生物信息学技术筛选出来的新型抗噬菌体防御系统。2024年1月4日,余雅梅副研究员/陈强研究员团队与美国俄亥俄州立大学傅天民课题组合作,在Nature Structural & Molecular Biology在线发表论文,揭示了新型抗噬菌体防御系统Septu的分子组装与抗噬菌体机制。
余雅梅副研究员、陈强研究员,傅天民助理教授为该文共同通讯作者;生物治疗全国重点实验室博士生李媛媛、张萌原,俄亥俄州立大学博士后沈张飞、博士生杨晓媛为共同第一作者。
Septu系统由PtuA和PtuB两个蛋白组成,PtuA包含ATP酶结构域,PtuB为HNH核酸酶家族成员。该研究采用冷冻电镜技术解析了分辨率为2.93 Å的PtuA和2.7 Å的PtuA-PtuB复合物的结构(图3)。PtuA以不对称形式组成马蹄形六聚体,该六聚体由三个PtuA二聚体组成,一个中心二聚体结合了两个ATP分子,两个侧面二聚体各结合了一个ATP分子。在PtuA-PtuB复合物中,PtuA六聚体作为骨架,与PtuB以6:2的分子比形成帽子形复合物。其中PtuA形成的马蹄形六聚体骨架组成了“帽身”,两个侧PtuA二聚体分别与一个PtuB蛋白结合,形成了“帽檐”。PtuA的每个侧面二聚体与一个PtuB分子相互作用,而中心二聚体则不结合PtuB分子,这暗示ATP的离开可能会引起PtuA的构象变化,从而招募PtuB。
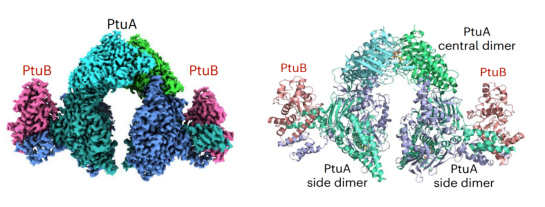
图3 PtuA-PtuB复合物冷冻电镜结构
研究者对PtuA的ATP酶活以及PtuA-PtuB复合物的核酸酶活性进行验证,证明PtuA仅能结合但无法水解ATP,PtuA-PtuB具有较强的核酸切口酶活性,并且受ATP的调控。体内实验证明Septu系统可以直接抑制噬菌体的复制。该论文总结Septu系统的作用机制为:噬菌体的入侵会激活PtuA进而募集PtuB形成复合物,大量切割噬菌体的核酸,影响噬菌体的复制,而NTP可以抑制其活性,这可能是激活Septu系统的信号分子。
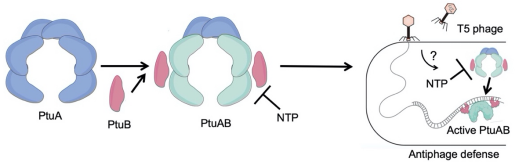
图4 Septu系统抵抗噬菌体感染的分子机制模式图
该研究以PtuA和PtuAB的冷冻电镜结构为基础,结合体内活性验证和蛋白质功能研究完整阐释了Septu系统抵抗噬菌体感染的分子机制,并提出这一系统与哺乳动物免疫系统中的NLRC4炎症小体的作用机制类似,这暗示着哺乳动物免疫系统相关蛋白可能起源于细菌的抗噬菌体防御系统。
原文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(23)00955-3