2021年5月,我院临床病理研究所/卫健委移植工程与移植免疫重点实验室石毓君研究员和肝脏外科/肝脏移植研究室杨家印教授团队联合在肝脏病学领域顶尖期刊《Hepatology》(IF:14.679)正式发表题为“Brahma-Related Gene 1 Inhibition Prevents Liver Fibrosis and Cholangiocarcinoma by Attenuating Progenitor Expansion”的研究论文,揭示了Brg1通过调控肝脏前体细胞(Hepatic progenitor cells, HPCs)增殖,促进肝纤维化和肝内胆管癌(iCCA)发生的分子机制。

iCCA是第二大肝脏原发肿瘤,恶性程度高,目前尚无针对性治疗方案,其预后甚至比肝细胞癌更差。肝脏受到多种慢性损伤刺激时,HPCs往往大量增生并伴随纤维化的发生;持续慢性损伤可能最终导致HPCs恶性转化,与iCCA发生密切相关,但HPCs活跃增生和恶性转化的分子机制并不清楚。Brg1是染色质重构复合体SWI/SNF的关键ATP水解酶活性亚基,利用ATP水解释放的能量改变染色质疏松程度,同时与不同转录因子结合,参与细胞增殖调控、干性维持以及损伤修复等多种活动,已证实其表达异常与肿瘤发生发展密切相关。
本研究中,研究人员首先证实Brg1在临床iCCA样本中高表达,且与不良预后有关。小鼠在含DDC饲料的诱导下,肝脏发生慢性损伤,HPCs显著活化,其Brg1表达显著上调。特异性敲除HPCs中Brg1后,HPCs增生能力显著减弱,同时肝纤维化程度也明显减轻。结合RNA-seq及体外实验,证实Brg1通过多途径调控Wnt/β-catenin信号通路,促进HPCs的增生和纤维化的发生。
进而,在长期硫代乙酰胺(thioacetamide, TAA)诱导的小鼠自发iCCA模型中,研究人员发现Brg1的诱导性敲除或小分子靶向抑制均可改善肝脏组织学,减轻肝纤维化程度,同时显著延缓或抑制肿瘤的发生发展。即使在已形成的肿瘤中,诱导性敲除或抑制Brg1仍能有效减缓甚至逆转iCCA的进展。
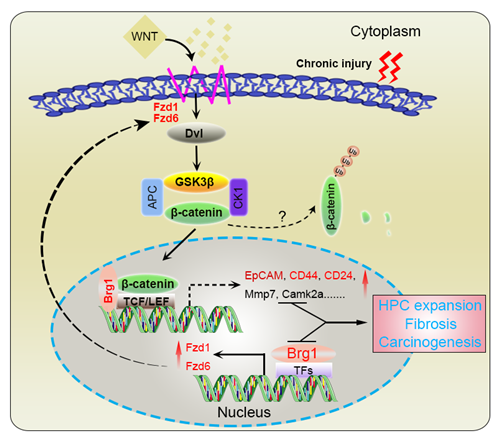
本研究详细阐明了Brg1激活Wnt/β-catenin信号通路,调控HPCs活化和iCCA发生的分子机制(如图所示),为iCCA的治疗提供了新靶点。鉴于Brg1在肝纤维化、HCC及iCCA发生发展中的重要作用,课题组已围绕该分子开展系列研究,在相关领域获得多项国家自然科学基金课题。
本文第一作者为四川大学华西医院周永杰助理研究员,通讯作者为石毓君研究员和杨家印教授。该工作得到了国家自然科学基金面上项目、青年项目、医院1.3.5项目、专职博士后基金等的资助。
文章链接:https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.31780