近日,我院眼科和生物治疗国家重点实验室张润东研究员团队在国际期刊《Nucleic Acids Research》 (影响因子为11.147) 在线发表题为“Negative cooperativity between Gemin2 and RNA provides insights into RNA selection and the SMN complex's release in snRNP assembly”的研究论文,揭示小核糖核蛋白复合体(small nuclear ribonucleoprotein particle, snRNP)组装的重要机制。该研究由张润东研究员团队独立完成,张润东研究员为通讯作者,博士研究生易红飞和牟莉为共同第一作者。
剪接体是真核细胞中负责将前体信使RNA(pre-mRNA)的非编码区剪除并将编码区拼接起来的主要分子机器。snRNP是剪接体的主要组成部件,包括U1,U2,U4和U5 snRNP等。它们共有一个组成和结构相同的核心:7个Sm蛋白,D1, D2, F, E, G, D3和B,环绕小核RNA(small nuclear RNA, snRNA)中的一个由9个核苷酸组成的Sm蛋白结合位点(Sm site)而形成的环状结构。在此核心的基础上,每个snRNP再各自招募不同的特异蛋白组成更大更复杂的成熟snRNP。snRNP在体内的生物合成是非常复杂的多步骤过程,经历了细胞核-细胞浆-细胞核三个阶段。snRNP核心的组装是其中一个重要环节,发生在细胞浆中。早在上世纪80-90年代,人们已经开始研究snRNP核心的组装,发现7个Sm蛋白组成3个亚复合体,D1/D2, F/E/G和D3/B。在体外将这3个亚复合体与仅有9个核苷酸的Sm蛋白结合位点AAUUUUUGG 孵育后即可得到稳定的snRNP核心(也称为Sm核心)。但1997年发现在细胞中snRNP核心的组装需要另外一个蛋白复合体—SMN(Survival of Motor Neuron)蛋白复合体。SMN蛋白表达的不足引起了人类运动神经元退行性病变脊髓性肌肉萎缩症(spinal muscular atrophy, SMA),并且人们发现SMN复合体介导的snRNP核心的组装是引起此疾病的重要途径。因此研究SMN复合体怎样帮助snRNP核心的组装既有基本生物学意义,又有重要医学价值。
为什么体外可以自发进行的Sm核心的组装反应,偏偏在真核细胞中需要一个复杂的SMN复合体(脊椎动物细胞中有9个成员蛋白:SMN,Gemin2-8和unrip)帮助呢?早在2002年一篇《Science》论文报道指出,SMN复合体发挥了必不可少的增加RNA组装进入Sm核心的特异性,避免Sm蛋白组装在其它RNA上的作用。2005年报道进一步指出,SMN复合体介导的组装进入Sm核心的RNA不仅需要Sm site,还需要其3’端有一个茎环结构。那么,SMN复合体如何增加RNA组装特异性?这是该领域的一个关键性的机制问题。虽然这十多年的研究提出了一些机制模型,但这些模型并不能满意地解释所有相关的现象。因此这一问题一直是未解之谜。另外SMN复合体在帮助snRNP核心组装之后如何解离下来也一直是该领域的不解之谜。
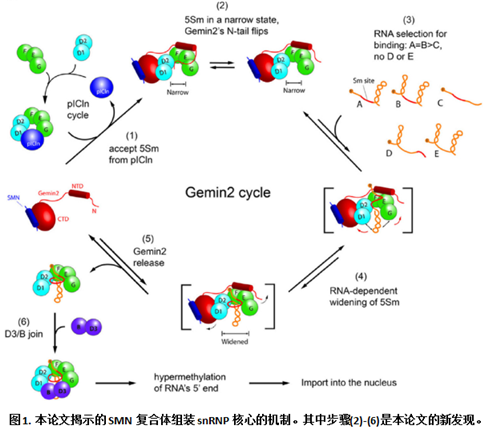
张润东研究员团队通过综合运用晶体学和生物化学等研究手段,细致地分析了SMN/Gemin2结合SmD1/D2/F/E/G形成组装中间体到snRNP核心组装完成的整个过程,发现了SMN复合体组装snRNP核心的全新机制。此机制一箭双雕,同时解开了以上两个持续多年的不解之谜。该论文揭示的新机制是:分别结合在马蹄状的SmD1/D2/F/E/G外部和内部的Gemin2和RNA可以别构性地相互抑制与SmD1/D2/F/E/G的结合,具有负协同(negative cooperativity)相互作用(图1)。具体而言,Gemin2结合在SmD1/D2/F/E/G外部,不依赖其N端尾巴,使其开口变窄[图1,步骤(1)-(2)],从而增加了RNA的组装特异性:能结合进入的RNA既需要Sm site又需要3’端的茎环结构[图1,步骤(3)]。而RNA结合进入SmD1/D2/F/E/G的内部后,撑开了其开口[图1,步骤(4)],导致SMN/Gemin2与SmD1/D2/F/E/G的亲合力变弱从而解离下来[图1,步骤(5)]。SmD1/D2/F/E/G的开口变宽还使得SmD3/B可以结合进入,从而完成snRNP核心组装,并且进一步促进了SMN/Gemin2的解离[图1,步骤(6)]。这一机制同时回答了SMN复合体如何增加RNA组装的特异性和如何解离下来的两个基本性问题。此机制可以满意地回答所有相关的现象,适用于所有真核细胞中剪接体snRNP核心组装,还应该适用于U7 snRNP核心的组装。另外,此机制的阐明对于脊髓性肌肉萎缩症的病生理研究也具有指导意义。
原文链接:https://doi.org/10.1093/nar/gkz1135